La metástasis es un proceso que implica pérdida de cohesión intercelular, migración celular, angiogénesis, acceso a la circulación sistémica, supervivencia en circulación, evasión de respuestas inmunitarias locales y crecimiento en órganos distantes (1,2).
El hueso es el tercer sitio más frecuente de metástasis, detrás del pulmón y el hígado (3). El cáncer de próstata y mama (BC) son responsables de la mayoría de las metástasis esqueléticas (hasta un 70%) (4). Esto refleja tanto la alta incidencia como la evolución clínica relativamente prolongada de estos tumores. Se desconoce la incidencia global de metástasis ósea (3). La incidencia relativa de metástasis ósea por tipo de tumor, en pacientes con enfermedad metastásica avanzada, es: 65-75% en BC; 65-75% en próstata; 60% en tiroides; 30-40% en pulmón; 40% en vejiga; 20-25% en carcinoma de células renales y 14-45% en melanoma. La mediana de supervivencia desde el diagnóstico de metástasis ósea es: 6 meses en melanoma; 6-7 meses en pulmón; 6-9 meses en vejiga; 12 meses en carcinoma de células renales; 12-53 meses en próstata; 19-25 meses en BC y 48 meses en tiroides (5),
Las metástasis óseas son una causa importante de morbilidad, caracterizada por dolor intenso, movilidad reducida, fracturas patológicas, compresión de la médula espinal, aplasia de la médula ósea e hipercalcemia (4).
Las metástasis óseas se clasifican en osteolíticas, osteoblásticas o mixtas, según el mecanismo principal de interferencia con la remodelación ósea normal:
Osteolítico, caracterizado por la destrucción del hueso normal, presente en mieloma múltiple (MM), carcinoma de células renales, melanoma, cáncer de pulmón de células no pequeñas, linfoma no Hodgkin, cáncer de tiroides o histiocitosis de células de Langerhans. La gran mayoría de CB produce metástasis osteolíticas. Esta destrucción ósea está mediada principalmente por osteoclastos y no es un efecto directo de las células tumorales (5,6). Otra vía, de menor importancia, es la compresión de la vasculatura y la consecuente isquemia en las etapas tardías del cáncer (3). El péptido relacionado con la hormona paratiroidea (PTHrP) tiene un papel importante en el desarrollo de lesiones osteolíticas (7). No está claro si el microambiente óseo induce a las células cancerosas a expresar PTHrP o si las células que hacen metástasis al hueso tienen una expresión intrínsecamente más alta de PTHrP (8). El receptor activador del ligando NF-kappaB (RANKL) juega un papel crítico en la formación de osteoclastos al estimular las células precursoras cuando se une al receptor activador de NF-kappaB (RANK) en la membrana celular de los precursores de osteoclastos (9).
Osteoblástico (o esclerótico), caracterizado por la deposición de hueso nuevo, presente en cáncer de próstata, carcinoide, cáncer de pulmón microcítico, linfoma de Hodgkin o meduloblastoma. Los mecanismos de las metástasis osteoblásticas aún no se conocen bien. En algunos casos, la nueva formación de hueso no está necesariamente precedida por resorción ósea (3). El factor de crecimiento transformante, las proteínas morfogénicas óseas (BMP) y la endotelina-1 están asociados con la generación de osteoblastos (10). El antígeno prostático específico (PSA) puede escindir la PTHrP, lo que permite que predomine la reacción osteoblástica al disminuir la reabsorción ósea (11). El factor de unión central alfal (Cbfal), también conocido como Runx-2, está relacionado con la diferenciación de osteoblastos (12).
Mixto, si un paciente tiene lesiones osteolíticas y osteoblásticas, o si una metástasis individual tiene componentes osteolíticos y osteoblásticos, presentes en BC, cánceres gastrointestinales y cánceres escamosos. Aunque el CB da origen predominantemente a lesiones osteolíticas, el 15-20% de las mujeres tienen lesiones osteoblásticas o ambos tipos de lesiones (13)
Las metástasis óseas son casi siempre múltiples y afectan al esqueleto axial (4). Se ha sugerido que esta distribución podría estar relacionada con la médula ósea roja hematopoyéticamente activa (13). Existe una red paravertebral que puede desempeñar un papel en el desarrollo de metástasis óseas (14). Esta teoría está respaldada por la alta incidencia de metástasis óseas sin lesiones correspondientes en el pulmón (sugiere una vía alternativa de diseminación). Además, el microambiente debe ser favorable para la supervivencia de las células tumorales (4)
Una vez que la célula tumoral está en circulación, necesita:
Adhesión y extravasación vascular: la célula interactúa con el endotelio para extravasarse y permanecer en un tejido específico (15). Las moléculas quimioatractivas y de adhesión juegan un papel fundamental en esta retención selectiva de células cancerosas en la vasculatura de la médula ósea. Las células cancerosas utilizan moléculas equivalentes a las moléculas de adhesión de células vasculares (VCAM) y E-selectina para adherirse al endotelio (16,17). También sabemos que las quimiocinas, integrinas, osteopontina, sialoproteína ósea y colágeno tipo I son fundamentales para la colonización de órganos por células cancerosas (18,19). Ejemplos de tales interacciones son: expresión de CXCR4 por tumores de neuroblastoma que media la unión al factor 1 derivado de células estromales en el hueso (SDF-1 o CXCL12); 20 expresión de RANK por BC que media la unión a RANKL en hueso; 21 expresión de sialoproteína por cáncer de pulmón de células no pequeñas que facilitan la unión al colágeno tipo I en el hueso (22)
Apoyo microambiental: la hipótesis de la semilla y el suelo nos dice que el microambiente proporciona un terreno fértil (el suelo), para la supervivencia y el crecimiento de las células cancerosas metastásicas (la semilla) (23) La formación y reabsorción ósea liberan y activan Factores que promueven la supervivencia y el crecimiento que pueden contribuir al desarrollo de metástasis óseas (24)
Transición epitelial – mesenquimatosa: la célula normal puede perder sus características epiteliales y adquirir características mesenquimales. Este proceso se denomina transición epitelial-mesenquimal y permite que las células epiteliales migren a un nuevo entorno. Esto ocurre principalmente durante la embriogénesis, pero en las células cancerosas este proceso confiere el fenotipo invasivo (4)
Epidemiología (25)
La Sociedad Estadounidense del Cáncer estima que en 2020:
Se diagnosticarán alrededor de 3.600 nuevos casos
Se esperan alrededor de 1.720 muertes a causa de estos tipos de cáncer.
Los casos de cáncer de hueso primario representan menos del 0,2% de todos los casos de cáncer.
En los adultos, más del 40% de los cánceres óseos primarios son condrosarcomas, seguidos de osteosarcomas (28%), cordomas (10%), tumores de Ewing (8%) e histiocitomas / fibrosarcomas fibrosos malignos (4%). Los casos restantes son varios tipos de tumores óseos raros.
En adolescentes (menores de 20 años), el osteosarcoma (56%) y los tumores de Ewing en niños (34%) son mucho más comunes que el condrosarcoma (6%).
Los condrosarcomas se observan con mayor frecuencia en adultos, con una edad promedio de 51 años en el momento del diagnóstico. Menos del 5% de los casos ocurren en pacientes menores de 20 años.
Los cordomas también son más comunes en adultos. Menos del 5% de los casos ocurren en pacientes menores de 20 años.
Tanto los osteosarcomas como los tumores de Ewing ocurren con mayor frecuencia en niños y adolescentes.
Signos y Síntomas
Dolor de huesos persistente que empeora con el tiempo y continúa hasta la noche.
Hinchazón y enrojecimiento (inflamación) sobre un hueso, que pueden dificultar el movimiento si el hueso afectado está cerca de una articulación.
Un bulto notable sobre un hueso.
Un hueso débil que se rompe (fractura) más fácilmente de lo normal
Factores de riesgo
Antecedentes familiares de determinadas enfermedades genéticas o cánceres raros …
Radioterapia o quimioterapia previa para tratar otro cáncer.
Enfermedad de Paget del hueso.
Tener ciertos tipos de tumores óseos o cartilaginosos.
Someterse a un trasplante de médula ósea.
Mortalidad
El pronóstico del osteosarcoma está influenciado por las variables que se tienen en cuenta para realizar la clasificación por estadios de esta enfermedad, las cuales se han mencionado en el capítulo correspondiente. El tipo histológico también influye.
Finalmente, los osteosarcomas desarrollados tras una alteración ósea previa (enfermedad de Paget) o en huesos que han recibido radioterapia, tienen un peor comportamiento que las formas clásicas.
En cuanto a los factores pronósticos que influyen en el osteosarcoma, serían:
Edad: la supervivencia suele ser menor en pacientes adultos que en pacientes más jóvenes (niños y adolescentes).
Resección quirúrgica completa. Es importante garantizar un resultado óptimo.
Estadio y grado del tumor.
Presencia de metástasis.
Recurrencia local.
Localización del tumor primario (los ubicados en las extremidades tienen mejor pronóstico).
Tamaño del tumor.
Como factores pronósticos del sarcoma de Ewing, se deben tener en cuenta datos clínicos como la edad, la ubicación del tumor, el tamaño y los tratamientos utilizados.
Edad: es controvertido, pero parece que cuanto más joven es, mejor pronóstico. Los 8 cm parecen ser un punto de corte importante.
Ubicación: los tumores localizados en las extremidades tienen mejor pronóstico que los localizados en el cráneo, la columna vertebral o la pelvis.
Tamaño: cuanto más pequeño es el tumor, mejor es el pronóstico.
Respuesta al tratamiento: Obviamente, cuanto mayor sea la respuesta, mejor será el pronóstico.
Marcadores moleculares: Actualmente se encuentran en estudio.
Metástasis: La existencia o no de metástasis es fundamental para el pronóstico. En general, los tumores metastásicos que solo presentan metástasis pulmonares tienen mejor pronóstico que si hay metástasis óseas u otros órganos.
El pronóstico, y por tanto la esperanza de vida de los pacientes con condrosarcoma, es mejor en mujeres, en edades tempranas, con estadio localizado, buen grado histológico, pequeño tamaño tumoral y en aquellas en las que ha sido posible la extirpación quirúrgica.
Por otro lado, los casos en hombres, en pacientes mayores, con extensión a distancia indiferenciada, mayor de 50 mm, en una localización vertebral o pélvica que han sido sometidos a radioterapia, tienen peor pronóstico.
La esperanza de vida a los 5 años es del 67,6% en casos localizados y del 26,5% si presentan metástasis a distancia. Ha ido aumentando a lo largo de los años, pasando del 64,4% en los casos diagnosticados entre 1973 y 1982 al 77,6% en los años 2001-2012.
En el caso de los condrosarcomas de bajo grado, donde la aparición de metástasis es poco frecuente, la supervivencia alcanza el 83% a los 5 años.
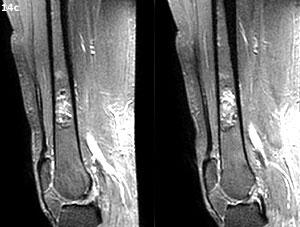
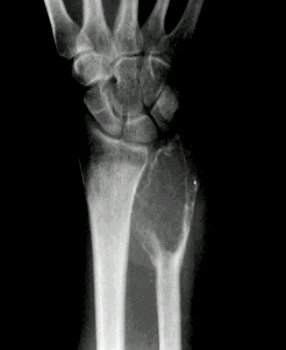
Bibliografía
- Chambers A, Naumov G, Varghese H, et al. Critical steps in hematogenous metastasis: an overview. Surg Oncol Clin N Am 2001;10:243-55.
- Luzzi KJ, MacDonald IC, Schmidt EE, et al. Multistep nature of metastatic inefficiency: dormancy of solitary cells after successful extravasation and limited survival of early micrometastases. Am J Pathol 1998;153:865-73.
- Coleman R. Metastatic bone disease: clinical features, pathophysiology and treatment strategies. Cancer Treat Rev 2001;27:165-76.
- Cecchini M, Wetterwald A, Pluijm G, Thalmann G. Molecular and biological mechanisms of bone metastasis. EAU Update Series 2005;3:214-26.
- Selvaggi G, Scagliotti G. Management of bone metastases in cancer: a review. Clin Rev Oncol Hematol 2005;56:365-78.
- Taube T, Elomaa I, Blomqvist C. Histomorphometric evidence for osteoclast-mediated bone resorption in metastatic breast cancer. Bone 1994;15:161.
- Southby J, Kissin M, Danks J, et al. Immunohistochemical localization of parathyroid hormone-related protein in human breast cancer. Cancer Res 1990;50:7710-6.
- Kohno N, Kitazawa S, Fukase M, et al. The expression of parathyroid hormone-related protein in human breast cancer with skeletal metastases. Surg Today 1994;24:215-20.
- Dougall W, Glaccum M, Charrier K, et al. Rank is essential for osteoclast and lymph node development. Genes Dev 1999;13:2412-24.
- Keller E, Zhang J, Cooper C, et al. Prostate carcinoma skeletal metastases: cross-talk between tumor and bone. Cancer Metastasis Rev 2001;20:333-49.
- Iwamura M, Hellman J, Cockett A, et al. Alteration of the hormonal bioactivity of parathyroid hormone-related protein (PTHrP) as a result of limited proteolysis by prostate-specific antigen. Urology 1996;48:317-25.
- Yang X, Karsenty G. Transcription factors in bone: developmental and pathological aspects. Trends Mol Med 2002;8:340-5.
- Coleman R, Seaman J. The role of zoledronic acid in cancer: clinical studies in the treatment and prevention of bone metastasis. Semin Oncol 2001;28:11-6.
- Berrettoni B.A, Carter JR. Mechanisms of cancer metastasis to bone. J Bone Joint Surg Am 1986;68:308-12.
- Franks LM. The spread of prostatic carcinoma to the bones. J Pathol Bacteriol 1953;66:91-3. [PubMed] [Google Scholar]
- Springer TA. Traffic signals for lymphocyte recirculation and leukocyte emigration: the multistep paradigm. Cell 1994;76:301-14. [PubMed] [Google Scholar]
- Mazo IB, von Andrian UH. Adhesion and homing of blood-borne cells in bone marrow microvessels. J Leukoc Biol 1999;66:25-32.
- Sipkins DA, Wei X, Wu JW, et al. In vivo imaging of specialized bone marrow endothelial microdomains for tumour engraftment. Nature 2005;435:969-73.
- Balkwill F. Cancer and the chemokine network. Nat Rev Cancer 2004;4:540-50.
- Guo W, Giancotti FG. Integrin signalling during tumour progression. Nat Rev Mol Cell Biol 2004;5:816-26.
- Russel H, Hicks J, Okcu M, Nuchtern J. CXCR4 expression in neuroblastoma primary tumors is associated with clinical presentation of bone and bone marrow metastases. J Pediatr Surg 2004;39:1506-11.
- Jones D, Nakashima T, Sanchez O, et al. Regulation of cancer cell migration and bone metastasis by RANKL. Nature 2006;440:692-6.
- Papotti M, Kalebic T, Volante M, et al. Bone sialoprotein is predictive of bone metastases in resectable non-small-cell lung cancer: a retrospective case-control study. J Clin Oncol 2006;24:4818-24
- Paget S. The distribution of secondary growths in cancer of the breast. Lancet 1889;1:571-3.
25 https://www.cancer.org/es/cancer/cancer-de-hueso/acerca/estadisticas-clave.html
Bibliografía de imágenes
1 https://www.google.com/url?sa=i&url=http%3A%2F%2Fwww.scielo.cl%2Fscielo.php%3Fscript%3Dsci_arttext%26pid%3DS0717-93082005000400005&psig=AOvVaw2iFGXZ4t0QEB3N3RvxJDDX&ust=1641509942528000&source=images&cd=vfe&ved=0CAwQjhxqFwoTCLjr_J3bm_UCFQAAAAAdAAAAABAD
2 https://www.google.com/url?sa=i&url=http%3A%2F%2Fwww.scielo.cl%2Fscielo.php%3Fscript%3Dsci_arttext%26pid%3DS0717-93082005000400005&psig=AOvVaw2iFGXZ4t0QEB3N3RvxJDDX&ust=1641509942528000&source=images&cd=vfe&ved=0CAwQjhxqFwoTCLjr_J3bm_UCFQAAAAAdAAAAABAJ
3 https://www.google.com/url?sa=i&url=https%3A%2F%2Fwww.medwave.cl%2Flink.cgi%2FMedwave%2FPuestaDia%2FCursos%2F3280&psig=AOvVaw2iFGXZ4t0QEB3N3RvxJDDX&ust=1641509942528000&source=images&cd=vfe&ved=0CAwQjhxqFwoTCLjr_J3bm_UCFQAAAAAdAAAAABAU
